 医疗器械企业受到行政处罚、刑事处罚怎么办?专业律师帮你忙!刘伟律师作为医疗器械法规律师,熟悉医疗器械行政监管的法律法规及行政机关办案流程,专业为医疗器械企业在接受行政机关监管中提供申辩、陈述、听证、法律意见、行... 详细>>
医疗器械企业受到行政处罚、刑事处罚怎么办?专业律师帮你忙!刘伟律师作为医疗器械法规律师,熟悉医疗器械行政监管的法律法规及行政机关办案流程,专业为医疗器械企业在接受行政机关监管中提供申辩、陈述、听证、法律意见、行... 详细>>
律师姓名:刘伟律师
手机号码:13381286399
邮箱地址:yangliu_1225@163.com
执业证号:11101200910110631
执业律所:北京雍文律师事务所
联系地址:北京市海淀区学院南路62号中关村资本大厦205室
医药网5月10日讯 2016年4月,国家食品药品监督管理总局对汕头市金丰医疗器械科技有限公司组织了飞行检查。检查中,发现该企业质量管理体系主要存在以下缺陷:
一、缺少人员培训的相关记录
未能提供产品制造人员具备相应资格或经过针对性的培训记录,不符合《医疗器械生产质量管理规范》及相关附录(以下简称《规范》)中要求应当经过与其岗位要求相适应的培训。
二、生产管理不到位
未制定受控的关键和特殊过程的作业指导书,且对关键和特殊过程的重要参数未进行验证或确认,不符合《规范》中要求应当明确关键工序和特殊过程,编制相应规程或指导书。
三、质量控制不到位
(一)试管高温消毒、生产过程真空度检测等抽验方法及判定规则描述不清,不符合《规范》中要求按强制性标准以及经注册或者备案的产品技术要求制定产品的检验规程。
(二)采血管容量及采血管泄露检验未按产品技术要求的规定执行,不符合《规范》中对产品检验的相关要求。
(三)现场未见产品标识及检验试验状态标识,不符合《规范》中对标识的相关要求。
四、未对质量管理体系的运行进行评价和审核
无定期对产品质量及质量管理工作进行审核、评审和评价的记录,不符合《规范》要求定期开展管理评审和内审,以确保其持续的适宜性、充分性和有效性。
企业已对上述质量管理体系存在缺陷予以确认。国家食品药品监督管理总局责成广东省食品药品监督管理局责令该企业立即停产整改,对涉及违反《医疗器械监督管理条例》及相关法律法规的,依法严肃处理。同时责成广东省食品药品监督管理局要求该企业评估产品安全风险,对有可能导致安全隐患的,应当按照《医疗器械召回管理办法》的规定,召回相关产品。
待企业完成全部项目整改并经所在地省级食品药品监督管理局跟踪复查合格后方可恢复生产。
2016年4月,国家食品药品监督管理总局对南京宏安医疗科技有限公司组织了飞行检查。检查中,发现该企业质量管理体系主要存在以下缺陷:
一、部分厂房设施不满足生产条件
(一)成品、原材料、包装材料储存在正修建的铁皮房中,铁皮房未封闭,不防水,不符合《医疗器械生产质量管理规范》及相关附录(以下简称《规范》)中要求满足相应储存条件的要求。
(二)库房无温湿度调控、监测设施,不符合《规范》中要求配备相适应的设施。
(三)无环氧乙烷解析库,不符合《规范》中要求配备相适应的场所。
(四)用于无菌医疗器械的内包装材料的生产车间设置在非洁净区内,不符合《规范》中有关车间的要求。
二、设计开发管理不到位
(一)无法提供完整的产品设计开发文档,不符合《规范》对文件保存的相关要求。
(二)未保持设计开发更改记录,不符合《规范》中对更改进行识别并保持纪录的要求。
三、部分质量控制文件缺失或擅自更改,质量控制不到位
(一)修改后的产品出厂检验规程与技术要求规定不一致,且不符合YY0338.1—2002的规定,不符合《规范》中要求按强制性标准以及经注册或者备案的产品技术要求制定产品的检验规程。
(二)未制定产品放行程序,未明确放行程度、条件和放行标准,不符合《规范》中对产品检验的相关要求。
(三)未按规定方法进行无菌检验,不符合《规范》中对产品检验的相关要求。
四、不合格品控制不到位
不合格(报废)的透析纸与合格的透析纸混放,未进行标识、记录、隔离、评审,不符合《规范》中对不合格品识别、控制的要求。
企业已对上述质量管理体系存在缺陷予以确认。国家食品药品监督管理总局责成江苏省食品药品监督管理局责令该企业立即停产整改,对涉及违反《医疗器械监督管理条例》及相关法律法规的,依法严肃处理。同时责成江苏省食品药品监督管理局要求该企业评估产品安全风险,对有可能导致安全隐患的,应当按照《医疗器械召回管理办法》的规定,召回相关产品。
待企业完成全部项目整改并经所在地省级食品药品监督管理局跟踪复查合格后方可恢复生产。
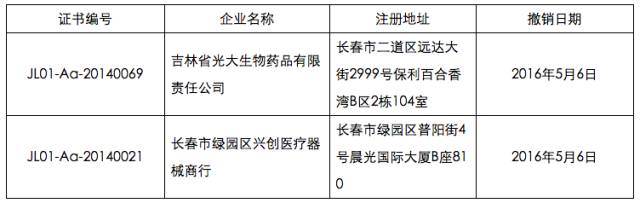
此外,5月6日,吉林省食品药品监督管理局发布《关于撤销吉林省光大生物药品有限责任公司等2家企业GSP认证证书的公告》(2016年第10号)。公告称,吉林省光大生物药品有限责任公司、长春市绿园区兴创医疗器械商行严重违反《药品经营质量管理规范》规定,依据《药品经营质量管理规范认证管理办法》第四十五条及国家食品药品监督管理总局《关于严格执行<药品经营质量管理规范>加强药品批发企业监督检查工作的通知》(食药监药化监〔2015〕85号)规定,依法撤销其《药品经营质量管理规范认证证书》,现予以公布。
免责声明:本网部分文章和信息来源于国际互联网,本网转载出于传递更多信息和学习之目的。如转载稿涉及版权等问题,请立即联系网站所有人,我们会予以更改或删除相关文章,保证您的权利。同时,部分文章和信息会因为法律法规及国家政策的变更失去时效性及指导意义,仅供参考。
联系方式:13381286399
北京市海淀区学院南路62号中关村资本大厦205室
Copyright © 2019 www.fzmlvshi.com All Rights Reserved.
技术支持:网律营管